2 × Taq PCR MasterMix
Funktsioonid
■ Kõrge amplifikatsioonitõhusus: erineva suurusega (alla 5 kb) DNA -fragmente ja allikaid saab tõhusalt amplifitseerida.
■ Kõrge tundlikkus: genoomsetest mallidest saab võimendada kuni 10 pg sihtfragmente.
■ Kõrge pingetaluvus: suure lisandite sisaldusega šabloonide, näiteks jämedalt ekstraheeritud matriitsi/bakterikultuuri puhul saab sihtfragmenti hõlpsasti amplifitseerida. Korduv külmutamine ja sulatamine ei mõjuta polümeraasi aktiivsust.
■ Mugav kasutamiseks: reaktsioonisüsteem valmistati lihtsalt ja kiiresti ette. Võimendatud fragment sisaldab 3'-otsa dA-üleulatust, mis on mugav TA kloonimiseks.
Spetsifikatsioon
Tüüp: Taq DNA polümeraas
Näide: Puhastatud/jämedalt ekstraheeritud matriits/bakterikultuur
Mall: > 10 lk
Fragmendi suurus: <5 kb
Rakendused: DNA fragmentide PCR amplifikatsioon, DNA märgistamine, praimeri pikendamine, järjestuse määramine, suuremahuline geenide tuvastamine, poolkvantitatiivsed PCR katsed, jälje DNA tuvastamine jne.
Kõiki tooteid saab kohandada ODM/OEM jaoks. Üksikasjade saamisekspalun klõpsake Kohandatud teenus (ODM/OEM)
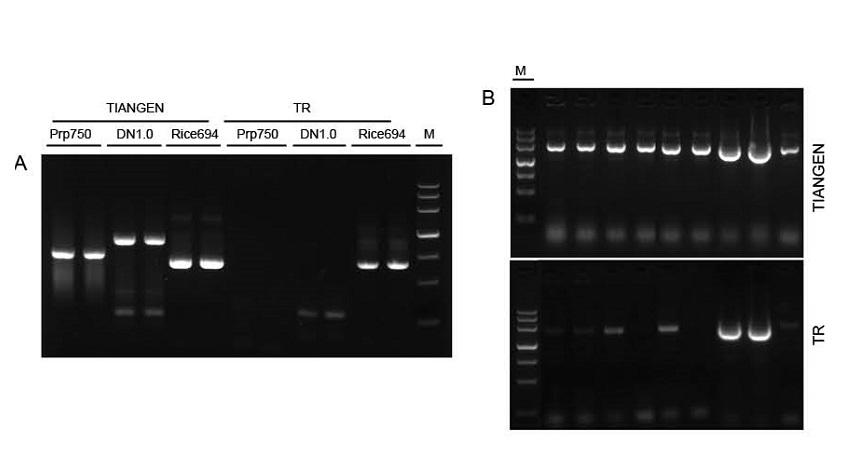 |
Joonis 1. Erinevatest allikatest pärinevaid malle võimendasid vastavalt TIANGEN Taq MasterMix II ja tarnija TR ühine Taq Mix, et tuvastada reagentide pingetaluvust. Tulemused näitavad, et TIANGENi tooted võivad võimendada toorgenoomsete mallide ja bakterikultuuri sihtfragmente ning stressitaluvus on parem kui tarnija TR. V: Toorne genoomne mall, mis on ekstraheeritud TIANGEN TIANcombi DNA Lyse & Det PCR komplektiga. Prp/DN: toornafta ekstraheerimine ja inimese vereproovide tuvastamine. Riis: toornafta ekstraheerimine ja riisiproovide avastamine. B: Koloonia PCR. PCR fragment on 700 bp. M: TIANGEN Marker III |
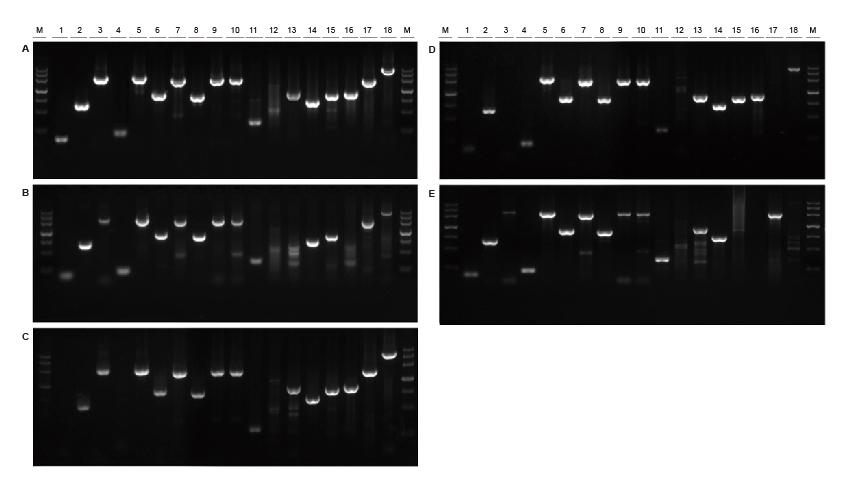 |
Hea universaalsus erinevatest allikatest ja erineva pikkusega mallide jaoks Joonis 2. TIANGENi abil võimendati erinevate allikate ja pikkuste fragmente Taq MasterMix II (A) ja tavaline Taq Tarnija TK (B), tarnija TR (C), tarnija V (D) ja tarnija G (E) segu. Tulemused näitavad, et TIANGEN toodete terviklik jõudlus on võimendusvõime, spetsiifilisuse ja universaalsuse poolest parim.M: TIANGEN Marker III1: sojaoa genoomne DNA mall (120 bp); 2-3: riisi genoomse DNA matriits (694 bp, 2258 bp); 4: puuvilla genoomne DNA mall (200 bp); 5: Escherichia coli genoomne DNA matriits (2298 aluspaari); 6-7: hiire genoomi DNA mall (1 kb, 2 kb); 8-10: roti genoomse DNA matriits (1 kb, 2 kb, 2080 bp); 11-18: inimese genoomi DNA mall (300 bp, 448 bp (GC%: 74,8%), 1100 bp, 750 bp, 1000 bp, 1090 bp (GC%: 70,4%), 2 kb, 4 kb) |
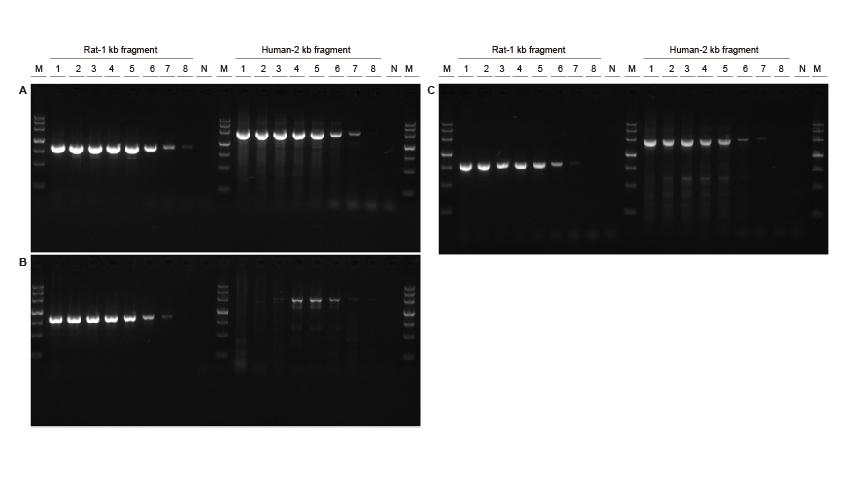 |
Kõrge tundlikkus Joonis 3. TIANGENi abil amplifitseeriti roti ja inimese DNA fragmentide erinevad kontsentratsioonid Taq MasterMix II (A), tavaline Taq Võimendustundlikkuse tuvastamiseks vastavalt tarnija V (B) ja tarnija TK (C) segu. Tulemused näitavad, et TIANGENi toode võib võimendada genoomimalli sihtfragmenti juba 0,01 ng ja selle tundlikkus on parem kui tarnija V ja TK toodetel. M: TIANGEN Marker III, N: NTCTemplate input 1-8 : 200 ng, 100 ng, 50 ng, 20 ng, 10 ng, 1 ng, 0,1 ng, 0,01 ng. |
A-1 mall
■ Mall sisaldab valgu lisandeid või Taq inhibiitoreid jne - puhastage DNA matriits, eemaldage valgu lisandid või ekstraheerige matriitsi DNA puhastuskomplektidega.
■ Malli denatureerimine pole lõpule viidud - suurendage sobivalt denatureerimise temperatuuri ja pikendage denatureerimisaega.
■ Malli halvenemine-valmistage mall uuesti ette.
A-2 Primer
■ Praimerite halb kvaliteet-sünteesige praimer uuesti.
■ Praimeri lagunemine - säilitamiseks salvestage kõrge kontsentratsiooniga praimerid väikesesse kogusse. Vältige mitmekordset külmutamist ja sulatamist või pikaajalist külmumist 4 ° C juures.
■ Praimerite vale disain (nt praimeri pikkus ei ole piisav, praimerite vahele on tekkinud dimeer jne) -Praimerite ümberkujundamine (vältige praimeri dimeeri ja sekundaarse struktuuri teket)
A-3 Mg2+kontsentratsioon
■ Mg2+ kontsentratsioon on liiga madal - suurendage korralikult Mg2+ kontsentratsioon: optimeerige Mg2+ kontsentratsioon reaktsioonide seeriaga vahemikus 1 mM kuni 3 mM intervalliga 0,5 mM, et määrata optimaalne Mg2+ kontsentratsioon iga malli ja praimeri kohta.
A-4 Lõõmutustemperatuur
■ Kõrge lõõmutamistemperatuur mõjutab praimeri ja matriitsi sidumist. —–Alandage lõõmutamistemperatuuri ja optimeerige seisundit 2 ° C gradiendiga.
A-5 Pikendusaeg
■ Lühike pikendusaeg - pikendamisaja pikendamine.
Nähtused: Negatiivsed proovid näitavad ka sihtjärjestuse ribasid.
A-1 PCR-i saastumine
■ Sihtjärjestuse või amplifikatsiooniproduktide ristsaastumine - Ärge püüdke sihtmärkjärjestust sisaldavat proovi pipeteerida negatiivse prooviga ega valage seda tsentrifuugitorust välja. Reaktiivid või seadmed tuleks autoklaavida olemasolevate nukleiinhapete kõrvaldamiseks ja saastumise olemasolu tuleks kindlaks teha negatiivsete kontrollkatsete abil.
■ Reagendi saastumine ——Alkoteerige reaktiivid ja hoidke madalal temperatuuril.
A-2 Primer
■ Mg2+ kontsentratsioon on liiga madal - suurendage korralikult Mg2+ kontsentratsioon: optimeerige Mg2+ kontsentratsioon reaktsioonide seeriaga vahemikus 1 mM kuni 3 mM intervalliga 0,5 mM, et määrata optimaalne Mg2+ kontsentratsioon iga malli ja praimeri kohta.
■ Ebaõige praimeri disain ja sihtjärjestus on homoloogia mittesihtjärjestusega. ——Projektide ümberkujundamine.
Nähtused: PCR-i amplifikatsiooniribad on vastuolus eeldatava suurusega, kas suured või väikesed, või mõnikord esinevad nii spetsiifilised võimendusribad kui ka mittespetsiifilised amplifikatsiooniribad.
A-1 Primer
■ Praimeri halb spetsiifilisus
——Re-design primer.
■ Praimeri kontsentratsioon on liiga kõrge - suurendage denatureerimise temperatuuri ja pikendage denatureerimisaega.
A-2 Mg2+ kontsentratsioon
■ Mg2+ kontsentratsioon on liiga kõrge - vähendage õigesti Mg2+ kontsentratsiooni: optimeerige Mg2+ kontsentratsioon reaktsioonide seeriaga vahemikus 1 mM kuni 3 mM intervalliga 0,5 mM, et määrata optimaalne Mg2+ kontsentratsioon iga malli ja praimeri kohta.
A-3 Termostabiilne polümeraas
■ Liiga suur ensüümikogus - vähendage ensüümi kogust sobivalt 0,5 Ü intervalliga.
A-4 Lõõmutustemperatuur
■ Lõõmutamistemperatuur on liiga madal-suurendage sobivalt lõõmutamistemperatuuri või kasutage kaheastmelist lõõmutusmeetodit
A-5 PCR tsüklit
■ Liiga palju PCR -tsükleid - vähendage PCR -tsüklite arvu.
A-1 Primer—— Halb spetsiifilisus —— Kavandage praimer uuesti, muutke praimeri asukohta ja pikkust, et suurendada selle spetsiifilisust; või teha pesastatud PCR.
A-2 malli DNA
——Mall ei ole puhas —— Puhastage mall või ekstraheerige DNA puhastuskomplektidega.
A-3 Mg2+ kontsentratsioon
- Mg2+ kontsentratsioon on liiga kõrge - vähendage õigesti Mg2+ kontsentratsioon: optimeerige Mg2+ kontsentratsioon reaktsioonide seeriaga vahemikus 1 mM kuni 3 mM intervalliga 0,5 mM, et määrata optimaalne Mg2+ kontsentratsioon iga malli ja praimeri kohta.
A-4 dNTP
—— dNTP -de kontsentratsioon on liiga kõrge —– vähendage sobivalt dNTP kontsentratsiooni
A-5 Lõõmutustemperatuur
——Liiga madal lõõmutamistemperatuur —– Tõsta lõõmutustemperatuuri sobivalt
A-6 tsüklit
—— Liiga palju tsükleid —— Optimeerige tsükli arvu

Esimene samm on valida sobiv polümeraas. Tavalist Taq polümeraasi ei saa korrigeerida 3'-5 'eksonukleaasi aktiivsuse puudumise tõttu ja mittevastavus vähendab tunduvalt fragmentide pikendamise efektiivsust. Seetõttu ei saa tavaline Taq polümeraas tõhusalt võimendada sihtfragmente, mis on suuremad kui 5 kb. Pikendamise efektiivsuse parandamiseks ja pika fragmendi võimendamise vajaduste rahuldamiseks tuleks valida spetsiaalse modifikatsiooniga Taq polümeraas või muu kõrge täpsusega polümeraas. Lisaks nõuab pikkade fragmentide võimendamine ka praimeri konstruktsiooni, denatureerimisaja, pikendamisaja, puhvri pH jms kohandamist. Tavaliselt võivad parema saagikusega kaasa tuua praimerid 18-24 bp. Malli kahjustuste vältimiseks tuleks denatureerimisaega 94 ° C juures lühendada 30 sekundini või vähem tsükli kohta ja temperatuuri tõusu aega 94 ° C -ni enne amplifikatsiooni vähem kui 1 minut. Veelgi enam, pikendustemperatuuri seadmine umbes 68 ° C ja pikendamisaja kavandamine vastavalt kiirusele 1 kb/min võib tagada pikkade fragmentide tõhusa amplifikatsiooni.
PCR -i amplifikatsiooni veamäära saab vähendada, kasutades erinevaid suure täpsusega DNA polümeraase. Kõigi seni leitud Taq DNA polümeraaside hulgas on Pfu ensüümil madalaim veamäär ja kõrgeim täpsus (vt lisatud tabelit). Lisaks ensüümide valikule saavad teadlased PCR -i mutatsioonikiirust veelgi vähendada, optimeerides reaktsioonitingimusi, sealhulgas puhvri koostise, termostabiilse polümeraasi kontsentratsiooni ja PCR -tsükli arvu optimeerimist.
Toote kategooriad
MIKS VALIDA MEID
Alates selle loomisest on meie tehas arendanud esmaklassilisi tooteid, järgides põhimõtet
kõigepealt kvaliteet. Meie tooted on saavutanud suurepärase maine tööstuses ja väärtuslikkuse uute ja vanade klientide seas.








