FastKing One Step RT-PCR komplekt
Funktsioonid
■ Puhtus: pöördtranskriptsioon ja PCR -reaktsioonid viiakse lõpule ühe sammuga, et vältida ristsaastumist.
■ Kõrge efektiivsus: ainulaadne Kingi pöördtranskriptaas, mille RT efektiivsus on üle 95%.
■ Tundlik: kuni 1 ng malle saab täpselt tuvastada, eriti madala arvukusega mallide puhul.
■ Spetsiifilisus: antikehaga modifitseeritud Taq polümeraas parandab veelgi amplifikatsiooni efektiivsust ja spetsiifilisust.
Rakendused
See sobib geeniekspressiooni taseme tuvastamiseks rakkudes ja kudedes, spetsiifiliste geenide cDNA kloonimiseks ja RNA viiruse tuvastamiseks. See sobib eriti madala arvukusega mallide kvalitatiivseks tuvastamiseks.
Kõiki tooteid saab kohandada ODM/OEM jaoks. Üksikasjade saamisekspalun klõpsake Kohandatud teenus (ODM/OEM)
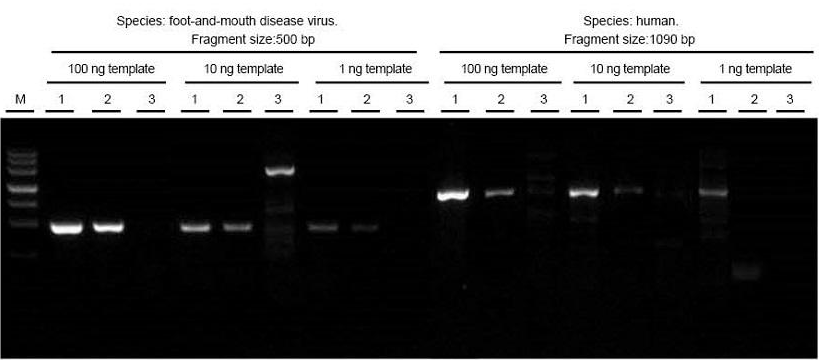 |
Suu- ja sõrataudi viiruse ja inimese koeproovide kogu RNA ekstraheeriti vastavalt. Pöördtranskript ja PCR erineva pikkusega sihtfragmendid, kasutades TIANGEN FastKing One Step RT-PCR komplekti (1), tarnija A (2) ja tarnija B (3) asjakohaseid tooteid ning jälgige pärast elektroforeesi PCR-tooteid. Tulemused näitavad, et FastKing One Step RT-PCR komplekti riba on selge ja särav, ilma sabata ja mittespetsiifiliste ribadeta ning 1 ng malli saab hästi tuvastada. TIANGENi katsetulemused on paremad kui asjakohaste toodete omad. |
A-1 RNA on lagunenud
—— Puhastage kvaliteetne RNA ilma saastumiseta. Materjal, millest RNA ekstraheeritakse, peaks olema RNA lagunemise vältimiseks võimalikult värske. Enne RT reaktsiooni analüüsige RNA terviklikkust denatureeritud geelil. Pärast RNA ekstraheerimist tuleb seda hoida 100% formamiidis. Kui kasutatakse RNaasi inhibiitorit, peaks kuumutamistemperatuur olema <45 ° C ja pH alla 8,0, vastasel juhul vabastab inhibiitor kogu seotud RNaasi. Lisaks tuleks RNaasi inhibiitorit lisada lahustesse, mis sisaldavad ≥ 0,8 mM DTT -d.
A-2 RNA sisaldab pöördtranskriptsiooni reaktsioonide inhibiitoreid
- Pöördtranskriptsiooni inhibiitorid hõlmavad SDS -i, EDTA -d, glütserooli, naatriumpürofosfaati, spermidiini, formamiidi, guanidiinisoola jne. Segage kontroll -RNA prooviga ja võrdle saagist kontroll -RNA reaktsiooniga, et kontrollida, kas inhibiitor on olemas. Peske inhibiitorite eemaldamiseks RNA sadestamist 70% (v/v) etanooliga.
A-3 cDNA esimese ahela sünteesimiseks kasutatavate praimerite ebapiisav lõõmutamine
—— Tehke kindlaks, kas lõõmutustemperatuur sobib katses kasutatud praimerite jaoks. Juhuslike heksameeride puhul on soovitatav hoida temperatuur 25 ° C juures 10 minutit enne reaktsioonitemperatuuri saavutamist. Geenispetsiifiliste praimerite (GSP) puhul proovige mõnda muud GSP-d või lülitage oligo (dT) või juhusliku heksameeri peale.
A-4 Väike kogus alustavat RNA-d
- Suurendage RNA kogust. Kui RNA proovid on väiksemad kui 50 ng, võib esimese ahela cDNA sünteesis kasutada 0,1 μg kuni 0,5 μg atsetüül -BSA -d
A-5 Sihtjärjestust ei ekspresseerita analüüsitud kudedes.
—– Proovige teisi kudesid.
A-6 PCR reaktsioon ebaõnnestub
—— Kaheastmelise RT-PCR puhul ei tohi cDNA matriits PCR etapis ületada 1/5 reaktsioonimahust.
A-1 Praimerite ja mallide mittespetsiifiline lõõmutamine
—— Praimerite 3'-ots ei tohiks sisaldada 2-3 dG ega dC. Kasutage esimese ahela sünteesis geenispetsiifilisi praimereid juhuslike praimerite või oligo (dT) asemel. Kasutage esimestel tsüklitel kõrgemat lõõmutamistemperatuuri ja seejärel madalamat lõõmutustemperatuuri. Reaktsiooni spetsiifilisuse parandamiseks kasutage PCR jaoks kuumkäivitusega Taq DNA polümeraasi.
A-2 Geenispetsiifiliste praimerite halb disain
—— Järgige amplifikatsioonipraimeri kujundamisel samu põhimõtteid.
A-3 RNA, mis on saastunud genoomse DNA-ga
——RNA töötlemine PCR-klassi DNaasiga I. DNA saastumise tuvastamiseks seadistage kontrollreaktsioon ilma pöördtranskriptsioonita.
A-4 Praimeri dimeeri moodustamine
—— Kujundage praimerid ilma komplementaarsete järjestusteta 3 'otsas.
A-5 Liiga kõrge Mg2+ kontsentratsioon
—— Optimeerige Mg2+ kontsentratsioon iga malli ja praimeri kombinatsiooni jaoks
A-6 Saastunud võõra DNA-ga
—Kasutage aerosoolikindlaid otsikuid ja UDG ensüüme.
A-1 Esimese ahela toote sisaldus on liiga kõrge
—— Vähendage esimese ahela produkti kogust tavapärases PCR reaktsioonietapis.
A-2 Liiga suur praimeri kogus PCR reaktsioonis
- Vähendage praimeri sisendit.
A-3 Liiga palju tsükleid
—— Optimeerige PCR reaktsioonitingimusi ja vähendage PCR tsüklite arvu.
A-4 Liiga madal lõõmutamistemperatuur
—– Suurendage lõõmutamistemperatuuri, et vältida mittespetsiifilist initsiatsiooni ja pikendamist.
A-5 DNA DNaasi lagundamisel tekkinud oligonukleotiidifragmentide mittespetsiifiline amplifikatsioon-ekstraheerige kvaliteetne RNA, et vältida DNA saastumist.
RT-PCR on RNA pöördtranskriptsioon cDNA-ks ja seejärel pöördtranskribeeritud cDNA kasutamine PCR-reaktsiooni mallina sihtmärgi fragmendi võimendamiseks. Valige vastavalt katse spetsiifilistele tingimustele kas juhuslikud praimerid, Oligo dT ja geenispetsiifilised praimerid. Kõiki ülaltoodud praimereid saab kasutada ilma juuksenõela struktuurita lühikese eukarüootsete rakkude mRNA jaoks.
Juhuslik praimer: sobib pikkade juuksenõela struktuuriga RNA-de jaoks, samuti igasuguste RNA-de jaoks, nagu rRNA, mRNA, tRNA jne. Neid kasutatakse peamiselt ühe matriitsi RT-PCR reaktsiooniks.
Oligo dT: sobib polüA -sabaga RNA -le (prokarüootsel RNA -l, eukarüootsel Oligo dT rRNA -l ja tRNA -l pole PolyA -saba). Kuna Oligo dT on seotud PolyA sabaga, peab RNA proovide kvaliteet olema kõrge ja isegi väike lagunemine vähendab oluliselt täispika cDNA sünteesi.
Geenispetsiifiline praimer: täiendab malli järjestust, sobib olukordades, kus sihtjärjestus on teada.
On kaks võimalust:
1. Sisemine võrdlusmeetod: teoreetiliselt on cDNA erineva pikkusega DNA fragmendid, seega on elektroforeesi tulemus määrdumine. Kui RNA arvukus on väike, ei kuvata elektroforeesis ühtegi toodet, kuid see ei tähenda, et PCR abil ei amplifitseerita ühtegi toodet. Üldiselt saab cDNA tuvastamiseks kasutada sisemist viidet. Kui sisemisel võrdlusel on tulemusi, saab cDNA kvaliteedi põhimõtteliselt garanteerida (mõnel juhul, kui sihtgeeni fragment on liiga pikk, võib esineda erandeid).
2. Kui on teada selle geeliga võimendatud geen, saab seda selle geeni praimeritega kontrollida. Sisemise viite võimendamine ei tähenda tingimata, et cDNA -ga pole probleeme. Kuna sisemisel võrdlusel on palju cDNA -d, on seda lihtne võimendada. Kui cDNA on erinevatel põhjustel osaliselt lagunenud, mõjutab see tõenäosuse seisukohast suuresti madala arvukusega sihtgeenide PCR tulemusi. Kuigi sisemist võrdlust on endiselt palju, ei mõjuta see võimendust tõenäoliselt.
RNA laguneb osaliselt. Tuvastage RNA terviklikkus ja puhastage
Erinevate liikide RNA sisaldus võib olla erinev, kuid üldiselt peaks ekstraheeritud kogu RNA sisaldama geelelektroforeesis kahte selget 28S ja 18S riba ning esimese riba heledus peaks olema kaks korda suurem kui teisel. 5S riba näitab, et RNA on lagunenud ja selle heledus on proportsionaalne lagunemisastmega. Sisemise viite edukas võimendamine ei tähenda, et RNA -ga poleks probleeme, sest sisemist viidet on palju, RNA -d saab amplifitseerida seni, kuni lagunemine ei ole tugev. OD260/OD280spektrofotomeetriga mõõdetud puhta RNA suhe peaks olema vahemikus 1,9 kuni 2,1. Väike kogus valgu lisandeid RNA -s vähendab suhet. Kuni väärtus pole liiga madal, ei mõjuta see RT -d. RT jaoks on kõige olulisem RNA terviklikkus.
Sisemise võrdlusgeeni pikendamine võib näidata ainult seda, et RT on õnnestunud, kuid see ei ole tingimata seotud cDNA ahela kvaliteediga. Kuna sisemised võrdlusfragmendid on üldiselt väikese suurusega ja kõrge ekspressiooniga, on neil lihtsam pöördtranskriptsioonis edu saavutada. Siiski on sihtgeeni suurus ja ekspressioon geeniti erinev. CDNA kvaliteeti ei saa hinnata ainult sisemise viite alusel, eriti sihtfragmentide puhul, mis on pikemad kui 2 kb.
Mõnel proovil on keerulised sekundaarsed struktuurid või rikkalik GC -sisaldus või need on vähese arvukusega. Nendel juhtudel tuleks vastavalt sihtfragmendi ja proovi suurusele valida sobiv pöördtranskriptaas. Kõrge GC sisaldusega ja keeruka sekundaarse struktuuriga RNA mallide puhul on sekundaarset struktuuri raske avada madalal temperatuuril või tavalise pöördtranskriptaasi korral. Nende mallide jaoks saab valida kvantpöördtranskriptaasi, kuna selle pöördtranskriptsiooni jõudlus on ilmselgelt parem kui M-MLV seeria pöördtranskriptaasil, mis suudab tõhusalt ümber transkribeerida erinevaid RNA malle ja transkribeerida RNA maksimaalselt cDNA esimesse ahelasse. Üldise pöördtranskriptaasi komplekti kasutamisel suudab 20 μl süsteem efektiivselt ümber kirjutada ainult 1 μg kogu RNA -d. Pöörake tähelepanu komplekti maksimaalsele RT võimsusele. Kui malli lisatakse liiga palju, soodustab pöördtranskriptsioon suure arvukusega RNA -d. Seetõttu on parem mitte ületada süsteemi maksimaalset võimsust.
A-1 Tehke kindlaks, kas RNA laguneb tugevalt ja kas RT on edukas
Üldiselt on sisemise võrdlusvõimenduse ebaõnnestumise põhjuseks sageli tõsine RNA lagunemine. Teine võimalik põhjus on pöördtranskriptsiooni ebaõnnestumine. Sisemist viidet ei saa standardina kasutada ühe ahela cDNA kvaliteedi hindamiseks, kuid seda saab kasutada standardina, et otsustada, kas pöördtranskriptsioon on edukas, kui RNA kvaliteediga pole probleeme. Reaktsioonitõhususe parandamiseks on pöördtranskriptsiooniprotsessis kõige olulisem säilitada püsiv temperatuur ja konstantne reaktsioonisüsteem.
A-2 Tehke kindlaks, kas sisemiste võrdlusgeenide võimendamise praimerid on usaldusväärsed ja kas PCR-is kasutatavate reagentidega on probleeme.
Suhtelise kvantifitseerimise jaoks tuleb RNA enne pöördtranskriptsiooni kvantifitseerida, mis on vajalik ka paljudes pöördtranskriptsioonikomplektides, näiteks kvantifitseeritakse RNA sisend 1 μg. Kuna pöördtranskribeeritud cDNA on segalahus, sealhulgas RNA, oligo dT, ensüüm, dNTP ja isegi väike DNA jääk, tekib kõrvalekalle, mistõttu on võimatu cDNA -d täpselt kvantifitseerida. Seetõttu on RNA kvantifitseerimine vajalik. Arvestades, et pöördtranskriptsiooni efektiivsus on erinevate proovide puhul sama, peaks saadud cDNA kogus olema sama ja kvantitatiivne analüüs võib näidata erinevate geenide ekspressioonitasemete võrdlust samas koguses kogu RNA -s. Suhtelise fluorestsentsi kvantitatiivse PCR -i läbiviimisel ei pruugi pärast pöördtranskriptsiooni nõuda kvantitatiivset cDNA -d, kuna sisemist võrdlusgeeni saab kasutada võrdlusena.
See on peamiselt seotud geenidega ja pika fragmendi pöördtranskriptsioon ei ole enamiku geenide jaoks teostatav. Esiteks on pöördtranskriptsiooni efektiivsus palju madalam kui PCR -il. Teiseks piiravad GC rikas piirkond ja paljude geenide sekundaarne struktuur nii pöördtranskriptsiooni kui ka PCR -i. Lõpuks on PCR -i täpsust ja võimendamise efektiivsust raske samaaegselt tagada. Pöördtranskriptsiooni käigus ei saa keegi garanteerida pikkade fragmentide saamist madala koopiaga geenide jaoks, eriti oligo dT abil. Mis puutub 5 'UTR -i, millel on rohkem GC -d, siis on see veelgi keerulisem. Seetõttu on endiselt mõistlik meetod transkriptsiooni tagasipööramiseks juhuslike praimeritega, sihtmärkfragmendi loomulike lõhustamiskohtade leidmiseks, segmentide kaupa võimendamiseks ning seejärel restriktsiooni lõhustamiseks ja ligeerimiseks. Üldiselt on raske üle 2 kb suuremaid fragmente otseselt võimendada, kuid alati pole võimatu neid saada: 1. Esiteks tagage RNA/mRNA terviklikkus ja eelistatakse TRIZOLi ekstraheerimist. 2. M-MLV RT-PCR komplekti saab otse kasutada. Pikendage lõõmutamisaega ja suurendage õigesti võimendusprotsessi tsüklite arvu. Teise võimalusena võib rakendada pesastatud PCR -i või viia läbi üks või kaks reaktsiooni, pikendades enne normaalset PCR -i amplifikatsiooni sobivalt pikendatud denatureerimis- ja pikendamisaega, mis võib aidata fragmente pikendada. Pöörake tähelepanu polümeraasi täpsusele. 3. Ideaalsete tulemuste saamiseks võib PCR -is kasutada pikka Taqi. 4. Valgu ekspressiooni rakendamiseks tuleks kasutada kõrge täpsusega polümeraasi.
TIANGEN pakub kahte tüüpi pöördtranskriptaasi: Quant/King RTase ja TIANScript M-MLV. Peamine erinevus nende vahel on mallide sisendkogus. Quant on ainulaadne pöördtranskriptaas, mis erineb tavaliselt kasutatavast M-MLV hiire Moloney leukeemia viirusest. Quant on uus suure efektiivsusega pöördtranskriptaas, mida ekspresseerib rekombinantselt Escherichia coli insener. Quant sobib 50 ng-2 μg RNA võimendamiseks, millel on kõrge pöördtranskriptsiooni aktiivsus ja kõrge saagis. Võrreldes tavalise MMLV või AMV -ga on Quanti suurim omadus see, et sellel on väga tugev afiinsus RNA mallidega ja see võib ümber pöörata keerulisi transkriptsioonimalle ilma kõrge temperatuuriga denatureerimiseta. Suurema GC -sisaldusega mallide puhul on vastupidine efektiivsus suurem. Sellel pöördtranskriptaasil on aga RNaas H aktiivsus, mis võib mõjutada cDNA produkti pikkust (sobib <4,5 kb mallide jaoks). Tavalise pöördtranskriptsiooni jaoks on soovitatav kasutada TIANScript MMLV pöördtranskriptaasi. See RTaas on modifitseeritud ensüüm, millel on väga nõrk RNaas H aktiivsus ja mis sobib pikaks (> 5 kb) cDNA sünteesiks.
Üheetapiline pöördtranskriptsioon ja PCR-amplifikatsioon viiakse läbi samas katseklaasis, avamata tuubikaant cDNA sünteesi ja amplifikatsiooni vahel, mis aitab vähendada saastumist. Kuna kõiki saadud cDNA proove kasutatakse amplifikatsiooniks, on tundlikkus suurem, minimaalselt 0,01 pg kogu RNA -st. Edukaks üheastmeliseks RTPCR-iks kasutatakse cDNA sünteesi alustamiseks üldiselt geenispetsiifilisi praimereid. Kaheastmeline meetod, nimelt pöördtranskriptsioon ja PCR amplifikatsioon, viiakse läbi kahes etapis. Esiteks teostatakse cDNA saamiseks pöördtranskriptsioon RNA matriitsilt ja saadud cDNA allutatakse ühele või mitmele erinevale PCR reaktsioonile. Kaheastmeline meetod võib kasutada oligo (dT) või juhuslikke praimereid, et juhtida cDNA esimese ahela sünteesi, ja võib pöördtranskribeerida kogu konkreetse proovi mRNA teabe.
Toote kategooriad
MIKS VALIDA MEID
Alates selle loomisest on meie tehas arendanud esmaklassilisi tooteid, järgides põhimõtet
kõigepealt kvaliteet. Meie tooted on saavutanud suurepärase maine tööstuses ja väärtuslikkuse uute ja vanade klientide seas.