Blood Direct PCR komplekt
Funktsioonid
■ Lihtne ja kiire: PCR -i amplifikatsiooni saab teha otse, kasutades matriitsina verd, ilma et oleks vaja teha tüütuid proovide ettevalmistamise ja DNA ekstraheerimise etappe.
■ Kõrge puhtusastmega: proovide eeltöötluse ja DNA ekstraheerimise etappide vahelejätmine võib aidata vältida proovide ristsaastumist.
■ Suur läbilaskevõime: suuremahuliste proovide PCR-i saab tuvastada, kombineerides komplekti 96/384-süvendiliste PCR-plaatidega.
■ Tugev universaalsus: see komplekt suudab tõhusalt võimendada kõrge GC -ga fragmente või keerulise teisese struktuuriga fragmente ning võimenduspikkus võib olla kuni 5 kb.
■ Tugev stressitaluvus: seda komplekti saab kasutada erinevate liikide ja erineval viisil säilitatud vereproovide jaoks.
Rakendused
Selle komplekti PCR tooted sisaldavad 3′-otsas “A”, mida saab otse kasutada TA vektori kloonimiseks. Seda komplekti saab kasutada genoomsete DNA fragmentide amplifitseerimiseks, suure läbilaskevõimega geneetiliseks analüüsiks ja genotüpiseerimise (näiteks geenide tuvastamise) analüüsiks.
Kõiki tooteid saab kohandada ODM/OEM jaoks. Üksikasjade saamisekspalun klõpsake Kohandatud teenus (ODM/OEM)
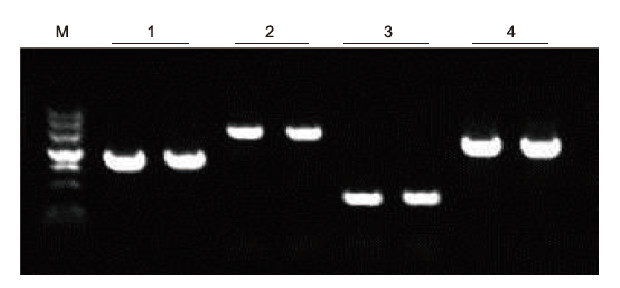 |
Kasutades mallina inimese EDTA antikoagulatsiooni, amplifitseeriti Blood Direct PCR komplektiga 4 erineva GC sisaldusega geeni. PCR reaktsioonisüsteem oli 20 μl ja mallina kasutati 1 μl verd. M: TIANGEN Marker II; 1: fragmendi suurus 1090 bp, GC sisaldus 68,1%; 2: fragmendi suurus 1915 bp, GC sisaldus 70,4%; 3: fragmendi suurus 448 bp, GC sisaldus 74,8%; 4: fragmendi suurus 1527 bp, GC sisaldus 61,5%. Katsetulemused: Blood Direct PCR Kit suudab tõhusalt võimendada DNA fragmente, mille GC sisaldus on vahemikus 61,5%-74,8%, mis viitab sellele, et see on võimeline võimendama kõrge GC-ga fragmente. |
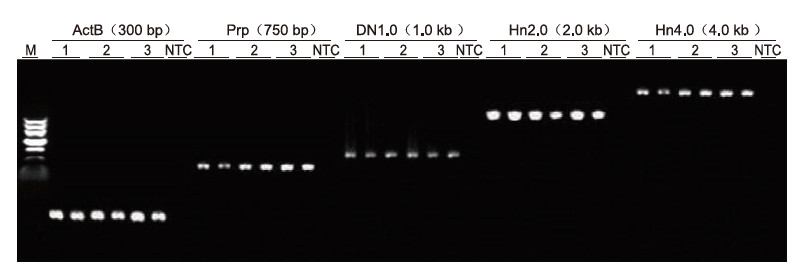 |
Kasutades matriitsina inimese EDTA antikoagulatsiooni, amplifitseeriti Blood Direct PCR komplektiga 5 erineva pikkusega geeni (ActB, Prp, DN1.0, Hn2.0 ja Hn4.0). PCR reaktsioonisüsteem oli 20 μl ja mallina kasutati 1 μl verd. M: TIANGEN Marker II; 1-3: 3 erinevat vereproovi; NTC: kontroll ilma praimeriteta. Katsetulemused: Blood Direct PCR komplekt võib võimendada kuni 4 kb pikkuseid fragmente, mis viitab sellele, et see on võimeline amplifitseerima pikki fragmente. |
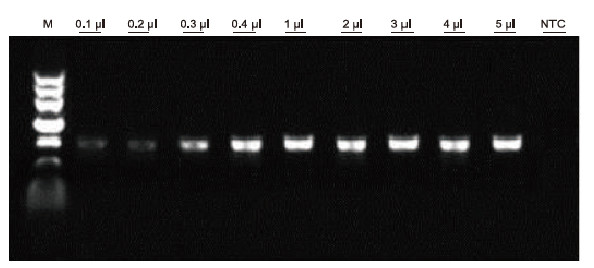 |
Kasutades mallina inimese EDTA antikoagulatsiooni, kasutati erinevate vereproovide PCR tuvastamiseks Blood Direct PCR komplekti. PCR reaktsioonisüsteem oli 20 μl ja mallina kasutati 1 μl verd. M: TIANGEN Marker II; 1-9: vere laadimiskogus on vastavalt 0,1 μl, 0,2 μl, 0,3 μl, 0,4 μl, 1 μl, 2 μl, 3 μl, 4 μl ja 5 μl; NTC: juhtimine ilma mallita Katsetulemused: Blood Direct PCR Kit on tugeva vereresistentsusega ja võib võimendada vereproove laadimisvahemikuga 0,1-5 μl. |
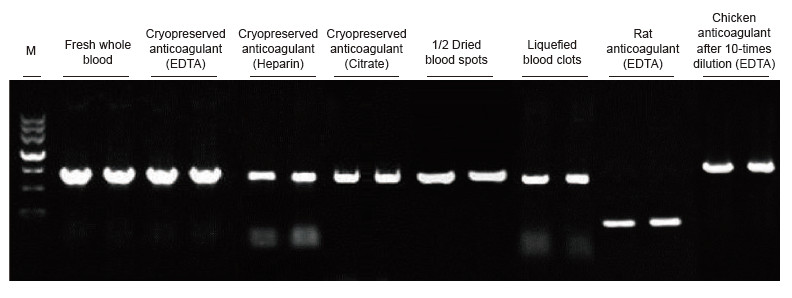 |
Mallidena kasutati erineva raviga inimeste, rottide, kanade ja teiste liikide vereproove. Blood Direct PCR komplekti kasutati PRNP (inimese, 750 bp), aktiini (rott, 200 bp) ja β-aktiini (kana, 1,0 kb) võimendamiseks. PCR reaktsioonisüsteem oli 20 μl ja mallina kasutati 1 μl verd. M: TIANGEN Marker II. Katsetulemused: Blood Direct PCR komplekti saab rakendada paljudele proovidele ja otsest PCR tuvastamist saab teha erinevate liikide vereproovidega erineva raviga. |
A-1 mall
■ Mall sisaldab valgu lisandeid või Taq inhibiitoreid jne - puhastage DNA matriits, eemaldage valgu lisandid või ekstraheerige matriitsi DNA puhastuskomplektidega.
■ Malli denatureerimine pole lõpule viidud - suurendage sobivalt denatureerimise temperatuuri ja pikendage denatureerimisaega.
■ Malli halvenemine-valmistage mall uuesti ette.
A-2 Primer
■ Praimerite halb kvaliteet-sünteesige praimer uuesti.
■ Praimeri lagunemine - säilitamiseks salvestage kõrge kontsentratsiooniga praimerid väikesesse kogusse. Vältige mitmekordset külmutamist ja sulatamist või pikaajalist külmumist 4 ° C juures.
■ Praimerite vale disain (nt praimeri pikkus ei ole piisav, praimerite vahele on tekkinud dimeer jne) -Praimerite ümberkujundamine (vältige praimeri dimeeri ja sekundaarse struktuuri teket)
A-3 Mg2+kontsentratsioon
■ Mg2+ kontsentratsioon on liiga madal - suurendage korralikult Mg2+ kontsentratsioon: optimeerige Mg2+ kontsentratsioon reaktsioonide seeriaga vahemikus 1 mM kuni 3 mM intervalliga 0,5 mM, et määrata optimaalne Mg2+ kontsentratsioon iga malli ja praimeri kohta.
A-4 Lõõmutustemperatuur
■ Kõrge lõõmutamistemperatuur mõjutab praimeri ja matriitsi sidumist. —–Alandage lõõmutamistemperatuuri ja optimeerige seisundit 2 ° C gradiendiga.
A-5 Pikendusaeg
■ Lühike pikendusaeg - pikendamisaja pikendamine.
Nähtused: Negatiivsed proovid näitavad ka sihtjärjestuse ribasid.
A-1 PCR-i saastumine
■ Sihtjärjestuse või amplifikatsiooniproduktide ristsaastumine - Ärge püüdke sihtmärkjärjestust sisaldavat proovi pipeteerida negatiivse prooviga ega valage seda tsentrifuugitorust välja. Reaktiivid või seadmed tuleks autoklaavida olemasolevate nukleiinhapete kõrvaldamiseks ja saastumise olemasolu tuleks kindlaks teha negatiivsete kontrollkatsete abil.
■ Reagendi saastumine ——Alkoteerige reaktiivid ja hoidke madalal temperatuuril.
A-2 Primer
■ Mg2+ kontsentratsioon on liiga madal - suurendage korralikult Mg2+ kontsentratsioon: optimeerige Mg2+ kontsentratsioon reaktsioonide seeriaga vahemikus 1 mM kuni 3 mM intervalliga 0,5 mM, et määrata optimaalne Mg2+ kontsentratsioon iga malli ja praimeri kohta.
■ Ebaõige praimeri disain ja sihtjärjestus on homoloogia mittesihtjärjestusega. ——Projektide ümberkujundamine.
Nähtused: PCR-i amplifikatsiooniribad on vastuolus eeldatava suurusega, kas suured või väikesed, või mõnikord esinevad nii spetsiifilised võimendusribad kui ka mittespetsiifilised amplifikatsiooniribad.
A-1 Primer
■ Praimeri halb spetsiifilisus
——Re-design primer.
■ Praimeri kontsentratsioon on liiga kõrge - suurendage denatureerimise temperatuuri ja pikendage denatureerimisaega.
A-2 Mg2+ kontsentratsioon
■ Mg2+ kontsentratsioon on liiga kõrge - vähendage õigesti Mg2+ kontsentratsiooni: optimeerige Mg2+ kontsentratsioon reaktsioonide seeriaga vahemikus 1 mM kuni 3 mM intervalliga 0,5 mM, et määrata optimaalne Mg2+ kontsentratsioon iga malli ja praimeri kohta.
A-3 Termostabiilne polümeraas
■ Liiga suur ensüümikogus - vähendage ensüümi kogust sobivalt 0,5 Ü intervalliga.
A-4 Lõõmutustemperatuur
■ Lõõmutamistemperatuur on liiga madal-suurendage sobivalt lõõmutamistemperatuuri või kasutage kaheastmelist lõõmutusmeetodit
A-5 PCR tsüklit
■ Liiga palju PCR -tsükleid - vähendage PCR -tsüklite arvu.
A-1 Primer—— Halb spetsiifilisus —— Kavandage praimer uuesti, muutke praimeri asukohta ja pikkust, et suurendada selle spetsiifilisust; või teha pesastatud PCR.
A-2 malli DNA
——Mall ei ole puhas —— Puhastage mall või ekstraheerige DNA puhastuskomplektidega.
A-3 Mg2+ kontsentratsioon
- Mg2+ kontsentratsioon on liiga kõrge - vähendage õigesti Mg2+ kontsentratsioon: optimeerige Mg2+ kontsentratsioon reaktsioonide seeriaga vahemikus 1 mM kuni 3 mM intervalliga 0,5 mM, et määrata optimaalne Mg2+ kontsentratsioon iga malli ja praimeri kohta.
A-4 dNTP
—— dNTP -de kontsentratsioon on liiga kõrge —– vähendage sobivalt dNTP kontsentratsiooni
A-5 Lõõmutustemperatuur
——Liiga madal lõõmutamistemperatuur —– Tõsta lõõmutustemperatuuri sobivalt
A-6 tsüklit
—— Liiga palju tsükleid —— Optimeerige tsükli arvu

Esimene samm on valida sobiv polümeraas. Tavalist Taq polümeraasi ei saa korrigeerida 3'-5 'eksonukleaasi aktiivsuse puudumise tõttu ja mittevastavus vähendab tunduvalt fragmentide pikendamise efektiivsust. Seetõttu ei saa tavaline Taq polümeraas tõhusalt võimendada sihtfragmente, mis on suuremad kui 5 kb. Pikendamise efektiivsuse parandamiseks ja pika fragmendi võimendamise vajaduste rahuldamiseks tuleks valida spetsiaalse modifikatsiooniga Taq polümeraas või muu kõrge täpsusega polümeraas. Lisaks nõuab pikkade fragmentide võimendamine ka praimeri konstruktsiooni, denatureerimisaja, pikendamisaja, puhvri pH jms kohandamist. Tavaliselt võivad parema saagikusega kaasa tuua praimerid 18-24 bp. Malli kahjustuste vältimiseks tuleks denatureerimisaega 94 ° C juures lühendada 30 sekundini või vähem tsükli kohta ja temperatuuri tõusu aega 94 ° C -ni enne amplifikatsiooni vähem kui 1 minut. Veelgi enam, pikendustemperatuuri seadmine umbes 68 ° C ja pikendamisaja kavandamine vastavalt kiirusele 1 kb/min võib tagada pikkade fragmentide tõhusa amplifikatsiooni.
PCR -i amplifikatsiooni veamäära saab vähendada, kasutades erinevaid suure täpsusega DNA polümeraase. Kõigi seni leitud Taq DNA polümeraaside hulgas on Pfu ensüümil madalaim veamäär ja kõrgeim täpsus (vt lisatud tabelit). Lisaks ensüümide valikule saavad teadlased PCR -i mutatsioonikiirust veelgi vähendada, optimeerides reaktsioonitingimusi, sealhulgas puhvri koostise, termostabiilse polümeraasi kontsentratsiooni ja PCR -tsükli arvu optimeerimist.
Toote kategooriad
MIKS VALIDA MEID
Alates selle loomisest on meie tehas arendanud esmaklassilisi tooteid, järgides põhimõtet
kõigepealt kvaliteet. Meie tooted on saavutanud suurepärase maine tööstuses ja väärtuslikkuse uute ja vanade klientide seas.








